
TP n°2 : les états de l'eau
L'eau se présente sous différentes formes :
- Solide : cet état est observé lorsque la température de l'eau est inférieure à 0°C. Dans cet état, l'eau est très compacte et très froide (tellement, que tu ne peux pas la garder longtemps dans tes mains).
- Liquide : entre 0°C et 100°C, l'eau est ni trop chaude, ni trop froide. Il est difficile de la prendre entre ses mains, car elle se faufile partout.
- Gazeux : au-dessus de 100°C, l'eau devient un gaz. Au quotidien, tu baignes dans les gaz : l'air est gazeux, et il existe naturellement de la vapeur d'eau autour de toi.
Fonte simple
La première expérience est toute simple à réaliser. Tu as besoin de :
- une petite assiette
- du sel de table
- une cuillère
- des glaçons

Dans une coupelle, place 2 glaçons et soupoudre l'un avec du sel. Patiente quelques minutes... Qu'observes-tu ?
Explication
On observe tout simplement que le glaçon salé disparaît plus rapidement. L'autre non salé continue de fondre mais a plus de mal.
Le passage de l'état solide à liquide s'appelle la "fusion".
On a dit que l'eau fond à 0°C, car c'est de l'eau pure. Mais en rajoutant du sel, l'eau n'est plus seule. On a un mélange "Eau + Sel". Ce couple a la particularité de fondre à une température inférieure à 0°C.
Et c'est carrément génial. Regarde l'hiver sur les routes quand il fait froid et qu'il y a plein de neige sur la route. C'est dangereux ! Eh bien, la solution est de rajouter du sel sur la route. La neige peut ainsi fondre même si la température est négative.
Refroidissement simple
La deuxième expérience traite du refroidissement de l'eau. Tu as besoin :
- d'un verre
- d'eau liquide
- de glaçons
- d'un thermomètre
- d'un tube à essai
Réalisation
Il faut impérativement noter la température initiale de l'eau. Nous avons obtenu 15°C.

Ensuite, rajoute des glaçons dans le verre. N'hésite pas à en mettre beaucoup. Tu vois immédiatement que la température diminue.

Nous remarquons plusieurs choses :
- on a besoin de beaucoup de glaçons
- l'eau liquide ne s'est pas solidifiée
- notre température a vraiment du mal à atteindre 0°C
Explication
C'est bizarre que l'eau ne se soit pas solidifiée ! Pourtant c'est tout à fait normal.
Quand l'eau change d'état (solide-liquide ou liquide-gazeux), l'eau n'est pas d'accord et elle résiste. Ainsi, pour la solidifier, il faut apporter beaucoup de froid. Inversement, pour la liquéfier, il faut lui fournir beaucoup de chaleur.
Dans notre expérience, il faudrait encore et toujours plus de glace.
Mais comme tu es futé, tu vas trouver le truc pour avoir quand même de la glace. Alors, n'attend plus pour passer à la prochaine manipulation !
Solidification
C'est là que ça va devenir étonnant. En plus du matériel de la précédente manipulation, il te faut du sel de table.
- Dans le verre que t'as refroidi, rajoute une énorme quantité de sel
- Remplit ton tube à essai d'eau du robinet, plonge le thermomètre dedans
- Place le tube dans le verre
- Agite le contenu du verre de manière à mélanger le sel tombé au fond

Explication
En se mélangeant à l'eau, le sel va diminuer la température de fusion de l'eau. Ce qui fait que la température de l'eau du verre va pouvoir descendre. Nous avons pu atteindre 0°C, et même un peu moins :

Mais attend... l'eau du tube n'est pas salée ! Et la température du verre est négative ! Donc, ça voudrait dire que le tube est à température négative. On a de la glace !!
La fraîcheur extrême du verre a encore refroidit le thermomètre. En sortant la glace du tube, on a pu observer un tube de glace. C'est impressionnant.
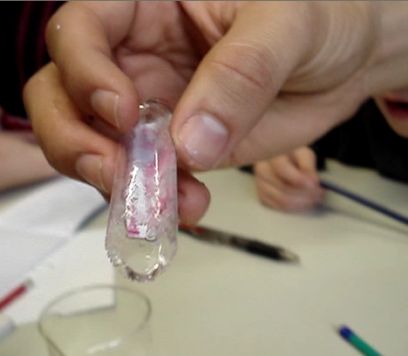
Conclusion

S'il y a du sel au fond du verre, c'est parce qu'on ne peut pas dissoudre une quantité énorme de sel dans l'eau. Il y a une limite. Une fois atteinte, on dit que l'eau est "saturée" en sel.
Dernière modification le 9 septembre 2012 à 16:57


